
Ny skala skriver om skolboken i kemi
Så kallad elektronegativitet är en av de mest välkända modellerna för att förklara varför kemiska reaktioner sker. Chalmers-forskaren Martin Rahm omdefinierar nu elektronegativitet i grunden med en ny, mer omfattande, skala.
Teorin kring elektronegativitet beskriver hur starkt olika atomer attraherar elektroner. Med hjälp av elektronegativitetsskalor kan man snabbt, utan kvantmekaniska beräkningar eller spektroskopiska studier, förutspå en ungefärlig laddningsfördelning i olika molekyler och material. Detta är mycket viktigt för förståelsen av alla möjliga typer av material och för att kunna designa nya. Elektronegativitet är ett centralt koncept som dagligen används av kemister och materialforskare över hela världen. Konceptet har sitt ursprung i den svenske kemisten Jöns Jacob Berzelius forskning på 1800-talet, och lärs ofta ut till elever redan på högstadiet.
Martin Rahm, forskarassistent inom fysikalisk kemi på Chalmers, har nu utvecklat en helt ny elektronegativitetsskala. Tillsammans med bland annat en nobelpristagare publicerar han studien i tidskriften Journal of the American Chemical Society.
En kemisk reaktion innebär att två eller flera ämnen reagerar med varandra så att ett eller flera nya ämnen bildas. Det som händer är att atomerna i ett ämne delar elektronerna med atomerna i det andra ämnet. Atomkärnan är positivt laddad med så kallad protoner och innehåller även neutrala partiklar som kallas neutroner. Elektronerna, lika många som protonerna, kretsar runt kärnan fördelade i olika skal. Det yttersta skalet innehåller de ”lösa” elektronerna, så kallade valenselektroner, som kan interagera med andra atomer. Väte (H) är det lättaste grundämnet med bara en proton och en elektron (atomnummer 1). Syre (O) innehåller åtta protoner och åtta elektroner (atomnummer 8). I syrets yttersta skal får det plats två elektroner extra. Därför ”lånar” syret gärna två elektroner av väte, vilket kräver två väteatomer. Det blir H2O, det vill säga vatten. Elektronegativitet är ett mått på hur starkt de olika atomerna i en molekyl attraherar elektroner, och indikerar därmed hur bindningen mellan två atomer kommer att se ut. Periodiska systemet är ett sätt att strukturera alla grundämnen efter dels atomnummer, dels antalet elektroner i yttersta skalet, vilket ger grundämnena liknande egenskaper i respektive kolumn.
96 grundämnen omfattas
– Den nya definitionen är den genomsnittliga bindningsenergin av de yttersta och svagast bundna elektronerna, de så kallade valenselektronerna. Vi har tagit fram värdena genom att kombinera experimentella data med kvantmekaniska beräkningar. I stora drag förhåller sig ämnena på samma sätt som tidigare, men den nya definitionen har även lett till att några grundämnen har bytt plats i elektronegativitetsordningen. Vissa grundämnen har även fått sin elektronegativitet uträknad för första gången, säger Martin Rahm.
Bland annat har både syre och krom flyttats i rangordningen i förhållande till närliggande ämnen i det periodiska systemet. Den nya skalan omfattar 96 grundämnen, vilket är en markant ökning jämfört med flera tidigare skalor. På detta sätt finns nu elektronegativitet att tillgå från den första atomen, väte eller H, till den nittiosjätte, curium, Cm.
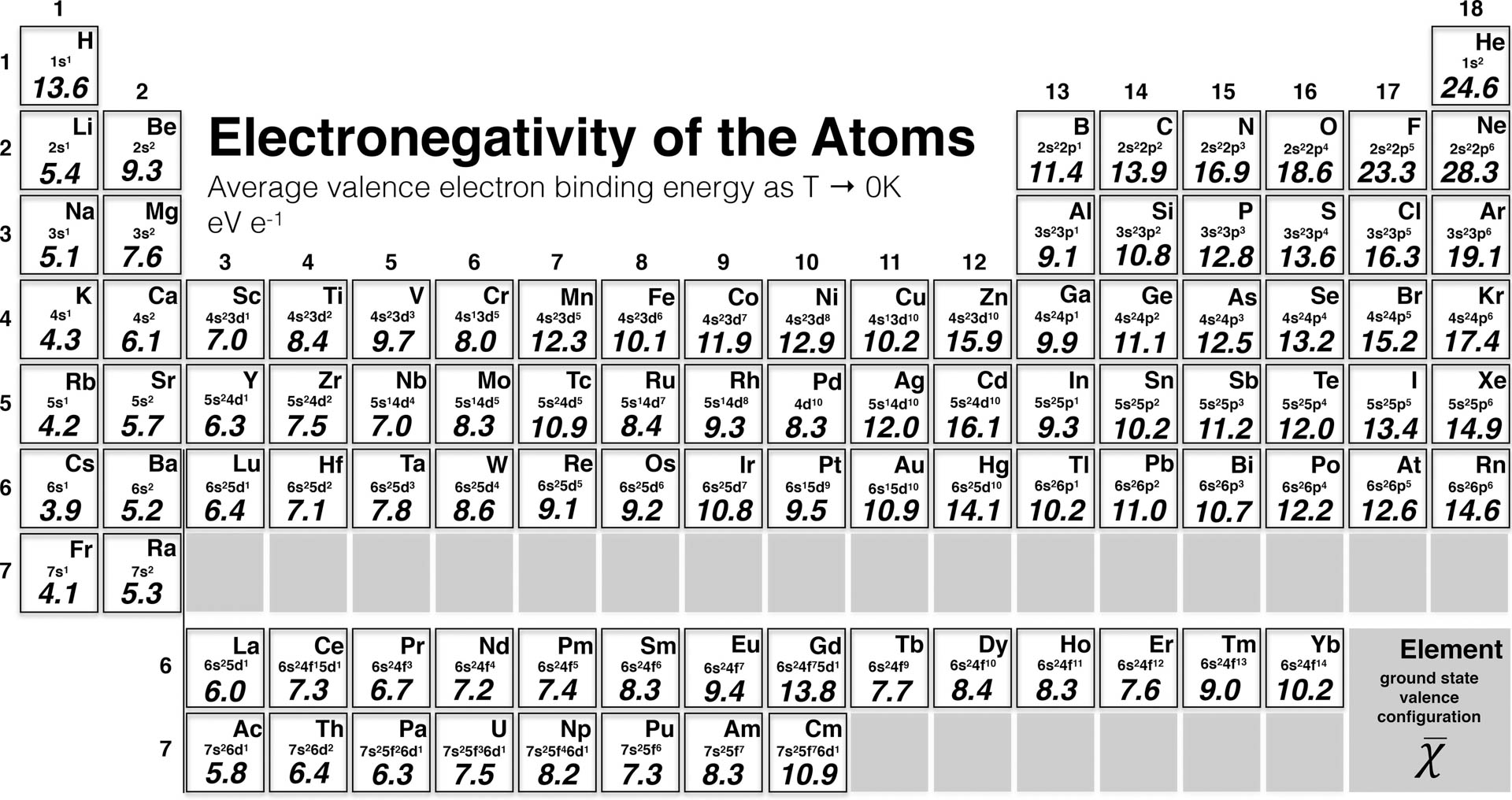
En motivation för forskarna att ta fram den nya skalan var att det visserligen finns flera olika definitioner på konceptet sedan tidigare, men att dessa enbart använts för att täcka upp delar av det periodiska systemet. En ytterligare utmaning för kemister är hur man kan förklara vad det innebär när elektronegativitet ibland misslyckas med att förutspå kemisk reaktivitet eller polaritet i kemiska bindningar.
Kemiska reaktioner med energiförändring
Ytterligare en fördel med den nya definitionen av elektronegativitet är att den ingår i ett ramverk som kan hjälpa till att förklara varför vissa kemiska reaktioner inte styrs av elektronegativitet. Förklaringen till sådana reaktioner handlar ofta om elektronernas komplicerade växelverkan med varandra. Vad som i själva verket bestämmer utgången för de flesta kemiska reaktioner är förändringar i den totala energin.
I sin förklaringsmodell presenterar forskarna en ekvation där den totala energin av en atom beskrivs som summan av två termer, där en term är elektronegativiteten och den andra beskriver elektronernas genomsnittliga växelverkan. Genom att beräkna hur storleken och tecknet på dessa termer förändras över en kemisk reaktion kan man förstå hur pass mycket elektronegativiten styr kemin.
Det finns oändligt många sätt att kombinera atomerna i det periodiska systemet och skapa nya material. Elektronegativitet ger en första viktig insikt i vad som kan förväntas från dessa kombinationer.
– Det är en omfattande skala som jag tror och hoppas kommer påverka forskning inom kemi och materialvetenskap. Elektronegativitet används rutinmässigt inom kemiforskning och med vår nya skala kommer arbetet underlättas då en mängd kvantmekaniska beräkningar kan undvikas. Den nya definitionen av elektronegativitet kommer även att kunna användas för att analysera elektronisk struktur som är kvantmekaniskt beräknad, genom att göra sådana resultat mer lättbegripliga, säger Martin Rahm.
Artikel:
Electronegativity Seen as the Ground-State Average Valence Electron Binding Energy (Journal of the American Chemical Society).
Fotnot:
Studien genomfördes tillsammans med kollegorna Roald Hoffmann, nobelpristagare i kemi, verksam vid Cornell University i USA och Tao Zeng vid Carleton University i Kanada.
Kontakt:
Martin Rahm, forskarassistent, Kemi och Kemiteknik, Chalmers, martin.rahm@chalmers.se




