Vid Parkinsons sjukdom klumpar proteinet alfasynuklein ihop sig i hjärnan. Detta förstör cellernas membran och cellerna dör. En ny metod som gör det möjligt att studera proteinernas interaktion med enskilda vesiklar i celler, har visat att membranets sammansättning spelar roll för hur mycket av proteinet som behövs för att göra skada.
Parkinsons sjukdom är en obotlig sjukdom där hjärnans nervceller, neuronerna, successivt bryts ner och hjärnans funktion rubbas. Detta leder bland annat till skakningar i kroppen och stort lidande hos de drabbande. För att kunna utveckla läkemedel som kan bromsa eller hindra sjukdomsförloppet försöker forskarna förstå de molekylära mekanismerna som ligger bakom nedbrytningen av neuronerna.
Det är känt att mitokondrierna, cellernas energikraftverk, skadas vid Parkinsons sjukdom. Detta sker troligen på grund av så kallade alfasynukleinaggregat, där flera proteiner har klumpat ihop sig, bundit till – och förstört – mitokondriernas membran. Men mekanismen bakom är ännu okänd.
Den nya studien, som nyligen publicerades i tidskriften PNAS, fokuserar på två sorters membranliknande vesiklar, det vill säga kapslar av konstgjorda cellmembran. En av dem har en lipidsammansättning som liknar den i synaptiska vesiklar, som ansvarar för hjärncellers kommunikation med varandra. Den andra sammansättningen efterliknar mitokondriemembran.
Parkinsonproteinet α-synuklein visade sig binda till båda membrantyperna, men orsakade endast stora strukturella förändringar och skador på de mitokondrieliknande vesiklarna, som deformerades och började läcka ut sitt innehåll.
Går att studera enskilda nanopartiklar
– Nu har vi utvecklat en metod som är känslig nog för att studera proteiners interaktion med enskilda vesiklar. I studien har vi sett att Parkinsonproteinerna binder till − och förstör − mitokondrieliknande membran även i mycket låga koncentrationer, nanomolar, där proteinet bara finns som monomerer, icke-aggregerade proteiner. Detta har inte kunnat studerats tidigare, men kan vara avgörande för sjukdomsförloppet, säger Pernilla Wittung-Stafshede, professor i kemisk ologi vid institutionen för biologi och bioteknik.
Den nya Chalmersmetoden gör att enskilda biologiska nanopartiklar kan studeras utan att använda fluorescerande markörer. Det är en stor fördel när man vill spåra naturliga reaktioner, eftersom markörerna ofta påverkar de reaktioner man vill observera. Detta gäller speciellt små proteiner som α-synuklein.
Parkinsonsproteiner med mutationer
– Skillnaden i kemi mellan de två lipidsorterna vi har använt är inte stor. Men vi kunde ändå se dramatiska skillnader i hur Parkinsonproteinet påverkade dem. Vi tror att det inte bara är den kemiska sammansättningen som avgör skeendet, utan att också makroskopiska skillnader hos de två membranerna bidrar till hur proteinet påverkar dem olika, till exempel hur rörliga lipiderna är och hur de växelverkar.
– Detta är ny kunskap eftersom man aldrig tidigare tittat noga på vad som händer med själva membranet när α-synuklein binder till det, säger Pernilla Wittung-Stafshede.
Nästa steg för forskarna är att titta på varianter av α-synuklein med mutationer som associeras med Parkinsons sjukdom, samt att undersöka lipidvesiklar som i större utsträckning liknar cellulära membraner.
Små variationer med stora konsekvenser
– Vi vill även göra kvantitativa analyser av reaktionerna för att på mekanistisk nivå förstå hur enskilda protein som associerar till ytan av membranet inducerar skador, säger Fredrik Höök, professor vid institutionen för fysik.
– Visionen är att ytterligare förfina metoden så att vi inte bara kan studera enstaka 100 nm små lipidvesiklar, utan också kunna följa varje protein ett och ett, trots att de bara är 1–2 nm stora. Det skulle leda till en förståelse av hur små variationer i cellmembranets egenskaper kan få så stora konsekvenser som vi nu har observerat.
Så gjorde forskarna
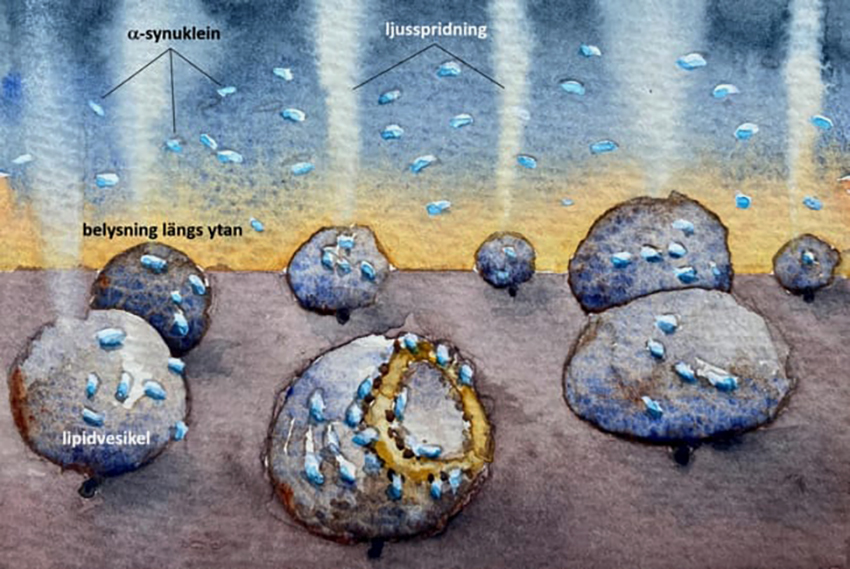
Effekten på vesikelmembranen observerades genom att mäta ljusspridning och fluorescens från vesiklar som bundits till en yta − och studera effekterna när låga koncentrationer av Parkinsonproteinet α-synuklein tillsattes.
Med hög tids- och rumsupplösning kunde bindningen, och de konsekvenser dessa reaktioner hade på vesiklarnas struktur, följas i realtid. Med hjälp av en ny teoretisk analys kunde de strukturella förändringarna i membranerna förklaras geometriskt.
Metoden som utnyttjats i studien är utvecklad av Björn Agnarsson i Fredrik Hööks grupp, och bygger på ljusvågledande sensor som är baserad på en kombination av polymer och glas. Medan glas ger goda förutsättningar för att leda ljuset till sensorer gör polymeren att ljuset inte sprids och ger upphov till bakgrundssignaler.
Kombinationen av god ljusledning och låg bakgrund gör det möjligt att detektera enstaka lipidvesiklar och mikroskopiskt följa deras dynamik när de växelverkar med omgivningen, till exempel protein som i den här studien. Sandra Rocha i Pernilla Wittung-Stafshedes grupp har stått för expertis runt α-synuklein, ett komplext protein att arbeta med.
Forskarnas kompletterande expertis kring protein, lipidmembran, optisk mikroskopi, teoretisk analys och design av sensorer i Chalmers renrum har varit avgörande för resultaten.
Vetenskaplig artikel:
Kontakt:
Pernilla Wittung-Stafshede, professor, institutionen för biologi och bioteknik, Chalmers, pernilla.wittung@chalmers.se
Fredrik Höök, professor, institutionen för fysik, Chalmers, fredrik.hook@chalmers.se