Förändring av en enda aminosyra i ett visst protein har spelat en viktig roll för hur strömmingen anpassat sig till Östersjöns ljusmiljö. Precis samma genetiska förändring finns hos cirka en tredjedel av alla världens fiskar som lever i sötvatten eller bräckt vatten.
– Vi har kartlagt hela arvsmassan från många populationer av sill och strömming och kan visa att förändring av en enda aminosyra i proteinet rodopsin har spelat en viktig roll för strömmingens anpassning till Östersjön. Det är fenylalanin som har bytts ut mot tyrosin i position 261, säger Jason Hill, forskare vid Uppsala universitet.
Studien publiceras i den vetenskapliga tidskriften PNAS.
Upptäckten är i högsta grad logisk eftersom rodopsin är en ljuskänslig receptor i näthinnan och satellitdata visar att Östersjön har en rödskiftad ljusmiljö, eftersom blått ljus tenderar att absorberas av organiskt material i vattnet.
– Den evolutionära processen måste ha gått mycket snabbt eftersom våra genetiska analyser visar att den genvariant som strömmingen har, ökade i frekvens från att ha varit en ny mutation till att bli den mest vanliga genvarianten på bara några hundra år, säger Mats Pettersson, forskare vid Uppsala universitet.
Sillen är lättstuderad
Det finns flera anledningar till att just sill och strömming är extra lämpade för evolutionära studier. Sillen har en enorm populationsstorlek som gör det möjligt att studera konsekvensen av naturlig selektion utan det brus som orsakas av de slumpmässiga förändringar som sker i små populationer. Det gör det möjligt att studera de genetiska förändringar som sker när en art anpassar sig till en ny miljö.
Strömmingen är en sorts sill som under de senaste 10 000 åren har anpassat sig från Atlantens marina miljö till ett liv i Östersjöns bräckta vatten. Genom att studera den evolutionära processen kan forskare få mer kunskap om hur biodiversitet uppkommer och kan bevaras.
Ser bättre i Östersjön med tyrosin
Aminosyrorna fenylalanin och tyrosin är nästan identiska och skiljer sig bara åt med förekomsten av en hydroxigrupp (-OH) i tyrosin. Kan den här lilla skillnaden verkligen vara så viktig för strömmingens evolution?
– Strukturmodellen för rodopsin visar dock att position 261 ligger alldeles i närheten av kromoforen retinal där själva ljusabsorptionen sker. Förekomsten av tyrosin i strömmingens rodopsin leder till en rödförskjutning i ljusabsorbansen, vilket innebär att näthinnan kan fånga fler fotoner i Östersjöns rödskiftade ljusmiljö, säger Leif Andersson, professor vid Uppsala universitet och Texas A&M University, som har lett studien.
När forskarna analyserade rodopsin-sekvensen från mer är tusen fiskarter fann de att cirka en tredjedel av alla fiskarter som lever i sött eller bräckt vatten har precis samma genetiska förändring som strömmingen medan däremot i stort sett alla marina fiskar har en variant med fenylalanin i position 261 som sillen.
– Det är häpnadsväckande att samma mutation har uppkommit oberoende av varandra ett tjugotal gånger under fiskarnas evolution. Detta utgör ett praktexempel på konvergent evolution på molekylär nivå, förklarar Jason Hill, vid Uppsala universitet.
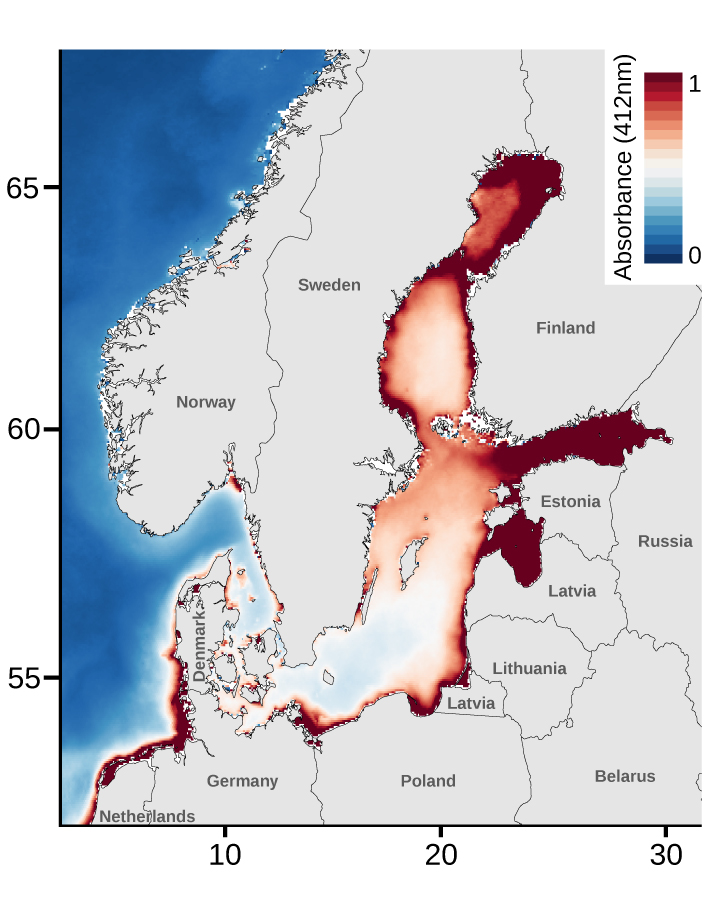
Modis-AQUA satellitdata som tydligt visar att Östersjön har en röd-skiftad ljusmiljö jämfört med Atlanten, på grund av förekomsten av organiskt material som absorberar blått ljus. Bild: Erik Enbody, Uppsala Universitet.
– Vår hypotes är att denna förändring i rodopsin är viktigast under yngelstadiet för strömmingen och att den gör så att de kan bättre utnyttja Östersjöns ljusmiljö för att hitta plankton och undvika rovfiskar, säger Leif Andersson.
Denna hypotes stöds av deras upptäckt att både lax och öring som alltid växer upp i sötvatten men kan spendera större delen av sitt liv i en marin miljö har tyrosin 261 i likhet med strömmingen och många sötvattensfiskar. I motsats till detta, så föds europeisk och japansk ål i havet men spenderar större delen av sitt vuxna liv i sötvatten, båda dessa arter har fenylalanin 261 liksom de allra flesta marina fiskar.
Vetenskaplig artikel:
Recurrent convergent evolution at amino acid residue 261 in fish rhodopsin. Jason Hill et al. (2019) 2019-08332, in PNAA
Kontakt:
Leif Andersson, Professor, institutionen för medicinsk biokemi och mikrobiologi vid Uppsala universitet och Texas A&M University, Leif.Andersson@imbim.uu.se