Ögonblicksbild av muskelprotein ökar förståelse för hjärtsjukdomar
Forskare vid Umeå universitet har ”filmat” ett protein som reglerar muskelavslappning, just i det kritiska skede då kalcium, som använts vid muskelkontraktion, pumpas från muskelcellen tillbaka till dess lagringsutrymme.
De molekylära mekanismerna för muskelfunktion är ännu inte helt kända. För att utföra livsviktiga processer i cellen krävs ofta att kroppens proteiner förändrar sin struktur. Denna flexibilitet har genom evolutionen blivit inkodad i proteinets aminosyrasekvens. För att förstå hur proteiner fungerar på molekylär nivå måste vi kartlägga hur de olika delarna av proteinet rör sig, det vill säga hur proteinet antar olika intermediära tillstånd.
En del intermediära tillstånd kan stabiliseras för att på så vis möjliggöra strukturbestämning, men de flesta tillstånd är tyvärr inte tillräckligt stabila för den typen av experiment. Genom att ”filma” reaktionen med snabba röntgenpulser direkt i den naturliga omgivningen kan man följa utvecklingen av intermediära tillstånd utan krav på konstgjord stabilisering.
Startat reaktionen indirekt med laser
Eftersom de strukturella förändringarna är väldigt små utförs experimenten vid synkrotroner som kan skjuta 1010 fotoner på provet under en 100 pikosekunders röntgenpuls. Metoden är relativt ny och har hittills varit begränsad till ljuskänsliga proteiner eftersom själva proteinreaktionen startas av en laserpuls.
I den nya studien har Magnus Andersson och hans team startat reaktionen indirekt genom att använda laser för att frigöra ATP från en ljuskänslig inaktiv ATP-förening.
– Det finns ett stort antal liknande ljuskänsliga föreningar för exempelvis signalsubstanser och metaboliter som i princip möjliggör liknande experiment för ett stort antal viktiga proteiner, säger Magnus Andersson, universitetslektor på Kemiska institutionen vid Umeå universitet.
Kalcium pumpas tillbaka
Det specifika proteinet som forskarna har studerat sköter muskelavslappning och är således viktigt för till exempel normal hjärtfunktion. För att muskler ska kunna slappna av måste kalcium som använts vid kontraktion pumpas tillbaka till sarkoplasmatiska retiklet, SR, ett rörliknande system som omger muskelcellen.
Kalcium kan inte passera SR-membranet av egen kraft utan pumpas av proteinet SERCA. Själva pumpningsprocessen är energikrävande och SERCA-proteinet sätter inte igång utan att först få tillgång till energibärande ATP. Trots att flera intermediära tillstånd har fångats med hjälp av molekyler som liknar ATP saknas information om hur proteinet ser ut på molekylär nivå i den kritiska övergången då proteinet öppnar sig mot SR-delen av cellen för att återföra kalcium och på så vis låta muskeln slappna av.
I en serie experiment vid ESRF-synkrotronen i Grenoble, Frankrike, samlade forskarna tidsupplösta röntgendata direkt i biologiska SR-membran, vars proteininnehåll till 90 procent består av SERCA-proteiner.
Många cirkulära membranfunktioner
– Eftersom mätningarna sker i en lösning bestående av många cirkulära membranfraktioner som rör sig fritt relativt varandra är den strukturella informationen lågupplöst utan detaljer. Vägen till en molekylär vy över den filmade reaktionen är i dagsläget långt ifrån standardiserad, säger Magnus Andersson.
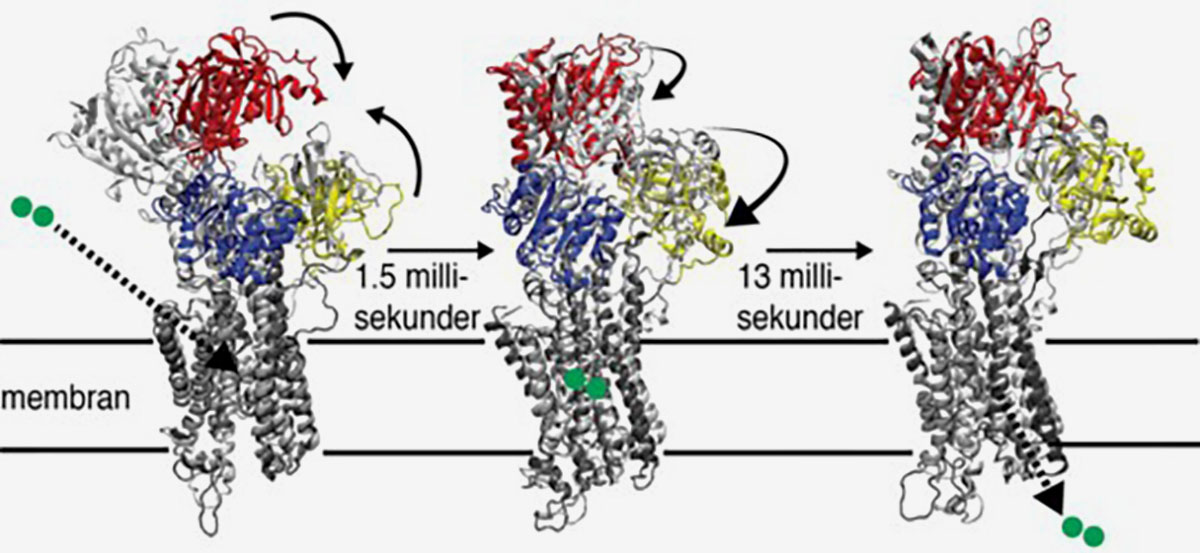
I studien utnyttjade forskarna kapaciteten hos dagens superdatorer och algoritmer och lyckades identifiera strukturer för två intermediära SERCA-tillstånd. I det först bildade tillståndet vid 1.5 millisekunder hade proteinet slutit sig kring ATP-molekylen och tagit upp kalcium från muskelcellen. Nästa observerade tillstånd bildades vid 13 millisekunder och visade på en hittills okänd proteinstruktur precis innan kalcium ska släppas tillbaka till sitt förvaringsutrymme.
Observationer av nya strukturer ökar vår förståelse för den underliggande molekylära mekanismen för muskelfunktion, som är viktig för att förstå exempelvis hjärtsjukdom.
Tidsupplöst röntgenspridning
– Tidsupplöst röntgenspridning möjliggör inte bara strukturbestämning av instabila tillstånd utan levererar också strukturer med en tidsstämpel. Det blir på så vis möjligt att undersöka hur olika tillstånd av proteinet utvecklar sig över tid och hur förloppet skiljer sig åt beroende på yttre faktorer såsom pH, temperatur, eller kemisk sammansättning, samt under förhållanden som är karakteriserande för sjukdom som till exempel vid mutation, säger Magnus Andersson.
Utvecklingen av synkrontonaläggningen MAX IV i Lund kommer förhoppningsvis möjliggöra den här typen av experiment också i Sverige inom en snar framtid.
Vetenskaplig artikel:
Ravishankar, H, Pedersen, M.N., Eklund, M, Sitsel, A., Li, C., Duelli, A., Levantino, M., Wulff, M., Barth, A., Olesen, C., Nissen, P., Andersson, M.: Tracking Ca2+ ATPase intermediates in real-time by X-ray solution scattering. Science Advances
Kontakt:
Magnus Andersson, Kemiska institutionen, magnus.p.andersson@umu.se