Nobelpriset i kemi 2018 går till Frances H. Arnold, George P. Smith och Sir Gregory P. Winter för att de har tagit kontroll över evolutionen och nyttjat den för ändamål som gör största nytta för mänskligheten. Enzymer framtagna genom riktad evolution används för att tillverka bland annat biobränslen och läkemedel. Antikroppar utvecklade med en metod kallad fagdisplay motverkar autoimmuna sjukdomar och kan i vissa fall bota spridd cancer.
En (r)evolution inom kemin, skriver Kungliga vetenskapsakademien i ett pressmeddelande.
Efter att det första fröet till liv uppstod för runt 3,7 miljarder år sedan har nästan varje skrymsle av jorden fyllts av olika organismer. Livet har kunnat sprida sig till djuphaven, varma källor och heta öknar eftersom evolutionen har löst en rad kemiska problem. Livets kemiska verktyg – proteinerna – har vässats, förändrats och förnyats och möjliggjort en fantastisk mångfald.
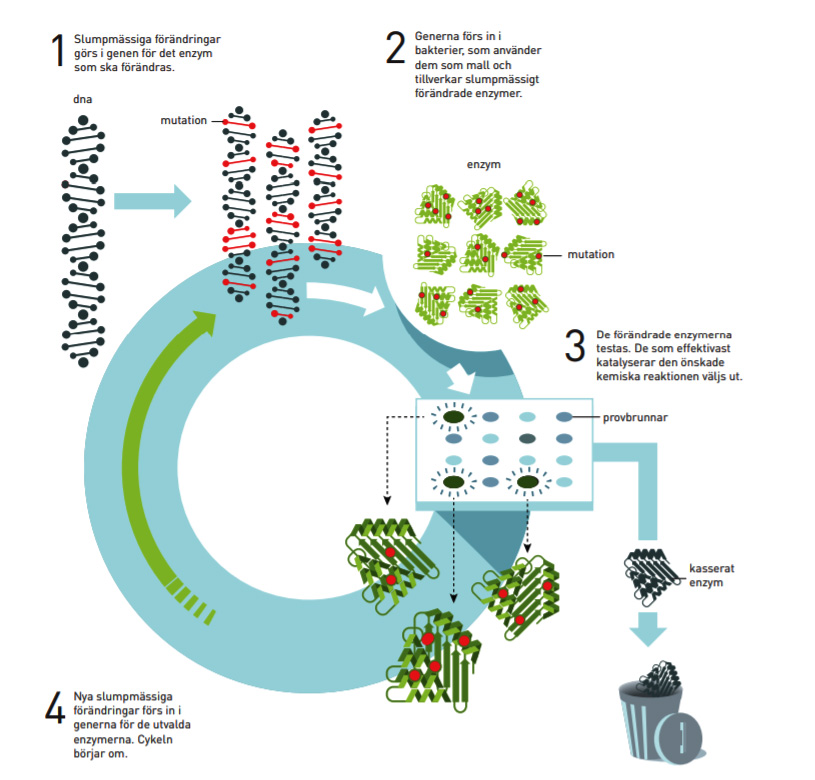
Den första riktade evolutionen av enzymer
Den ena halvan av årets kemipris tilldelas Frances H. Arnold. 1993 genomförde hon den första riktade evolutionen av enzymer (proteiner som katalyserar kemiska reaktioner). Sedan dess har hon slipat fram de metoder som numera används rutinmässigt för att utveckla nya katalysatorer. Frances Arnolds enzymer nyttjas bland annat för en mer miljövänlig tillverkning av kemiska substanser, som läkemedel, och för att framställa förnybara bränslen för en grönare transportsektor.
Istället för att tillverka läkemedel, plaster och andra kemikalier med traditionell kemi, som ofta kräver starka lösningsmedel, tungmetaller och frätande syror, var Nobelpristagaren Frances Arnold idé att ta hjälp av livets kemiska verktyg: enzymer. De katalyserar de kemiska reaktioner som sker i jordens alla organismer, och om hon lärde sig formge nya enzymer skulle hon kunna förändra kemin i grunden.
Arnold börjar leka med evolutionen
Till en början försökte Frances Arnold, liksom flera andra forskare mot 1980-talets slut, att på rationell väg tänka ut hur enzymer skulle byggas om för att få nya egenskaper, men enzymer är extremt komplexa molekyler. De byggs av 20 olika slags byggstenar – aminosyror – som kan kombineras i det oändliga.
Ett enda enzym kan bestå av flera tusen aminosyror. De länkas samman i långa kedjor som veckas till en tredimensionell struktur. I det inre av denna struktur skapas den miljö som krävs för att katalysera en viss kemisk reaktion. Att på logisk väg försöka räkna ut hur denna invecklade arkitektur ska göras om för att ett enzym ska få nya egenskaper är svårt även med dagens kunskap och datorkraft.
Ödmjuk inför naturens överlägsenhet beslöt sig Arnold i början av 1990-talet för att överge denna, med hennes egna ord, ”något förmätna väg” och istället låta sig inspireras av naturens egen metod för att optimera kemi: evolutionen.
Olika varianter av subtilisin
Under flera år hade hon försökt förändra ett enzym kallat subtilisin så att det i stället för att katalysera kemiska reaktioner i en vattenlösning skulle fungera i ett organiskt lösningsmedel, dimetylformamid (DMF). Nu skapade hon slumpmässiga förändringar – mutationer – i den genetiska koden för enzymet. Sedan förde hon in dessa förändrade gener i bakterier som tillverkade tusentals olika varianter av subtilisin. Därefter var utmaningen att ta reda på vilken av alla dessa varianter som fungerade bäst i lösningsmedlet.
Inom evolutionen pratar man om survival-of-the-fttest, inom den riktade evolutionen kallar man detta steg för selektion. Frances Arnold utnyttjade att subtilisin bryter ner mjölkproteinet kasein. Den variant av subtilisin som effektivast bröt ner kasein i en lösning med 35 procent DMF valde hon ut. I detta subtilisin införde hon sedan en ny omgång slumpvisa förändringar, och fck då fram en variant som fungerade ännu bättre i DMF.
I den tredje generationen av subtilisin hittade hon en variant som fungerade 256 gånger bättre i DMF än ursprungsenzymet. Enzymet innehöll en kombination av tio olika förändringar som ingen på förhand hade kunnat räkna ut skulle behövas. I och med detta visade Frances Arnold vilken kraft det fnns i att låta slumpen och riktad selektion,
istället för enbart mänsklig rationalitet, styra över utvecklingen av nya enzymer. Det var det första och avgörande steget mot den revolution vi ser i dag.
Ett andra viktigt steg tog Willem P. C. Stemmer, en holländsk forskare och entreprenör som gick bort 2013, när han införde ännu en dimension i den riktade evolutionen av enzymer: parning i provrör.
Parning – för en stabilare evolution
En förutsättning för den naturliga evolutionen är att gener från olika individer blandas med varandra genom till exempel parning eller pollinering. Fördelaktiga egenskaper kan då kombineras och ge upphov till en än mer livskraftig organism. Samtidigt kan mindre funktionella förändringar i arvsmassan försvinna från en generation till en annan.
Willem Stemmer utnyttjade provrörets motsvarighet till parning: DNA-shufing. År 1994 visade han hur man kan klippa olika versioner av en gen i smådelar och sedan, med hjälp av DNA-teknikens verktyg, pussla ihop delarna till en fullständig gen, som blir en mosaik av de ursprungliga versionerna.
Genom flera cykler av DNA-shufing förändrade Willem Stemmer ett enzym så att det blev väldigt många gånger efektivare än ursprungsenzymet. Det visade att parning av gener – forskare kallar det för rekombination – kan ge en ännu efektivare evolution av enzymer.
Nya enzymer ger hållbart biobränsle
Sedan det tidiga 1990-talet har DNA-teknikens verktyg fnslipats och metoderna för riktad evolution blivit många fler. Frances Arnold har gått i spetsen för denna kreativa utveckling. De enzymer som numera tas fram i hennes laboratorium kan katalysera kemi som inte ens finns i naturen och ge helt nya material. Hennes specialframställda enzymer har också blivit viktiga verktyg för tillverkning av olika kemiska substanser, exempelvis läkemedel. De kemiska reaktionerna går snabbare, ger mindre biprodukter och i vissa fall kan man även slippa de tungmetaller som den traditionella kemin kräver,
vilket minskar miljöbelastningen avsevärt.
Hennes forskargrupp har också utvecklat enzymer som omvandlar enkla sockerarter till isobutanol, ett energirikt ämne från vilket det går att tillverka både biobränsle och miljövänligare plast. Ett långsiktigt mål är att ta fram drivmedel för en grönare transportsektor. Alternativa bränslen – producerade med hjälp av Arnolds proteiner – fungerar både i bilar och fygplan. På detta vis bidrar hennes enzymer till en
grönare värld. Källa: Kungliga vetenskapsakademien
Den andra halvan av årets kemipris delas mellan George P. Smith och Sir Gregory P. Winter. År 1985 utvecklade George Smith en elegant metod som kallas för fagdisplay, där bakteriofager – virus som infekterar bakterier – kan utnyttjas för att ta fram nya proteiner.
Gregory Winter använde fagdisplay för riktad evolution av antikroppar, med målet att framställa nya läkemedel. Det första, adalimumab, godkändes 2002 och används mot ledgångsreumatism, psoriasis och inflammatoriska tarmsjukdomar. Fagdisplay har sedan dess gett antikroppar som kan neutralisera gifter, motverka autoimmuna sjukdomar och bota spridd cancer.
Vi är i början av den riktade evolutionens revolution, som på många olika vis gör den största nytta för mänskligheten, skriver Kungliga vetenskapsakademien i sitt pressmeddelande.
Mer om pristagarna:
- Frances H. Arnold, Född 1956 (62 år) i Pittsburgh, USA. Fil.dr 1985 vid University of California, Berkeley, USA. Linus Pauling. Professor of Chemical Engineering, Bioengineering and Biochemistry vid California Institute of Technology, Pasadena, USA.
- George P. Smith, född 1941 (77 år) i Norwalk, USA. Fil.dr 1970 vid Harvard. University, Cambridge, USA. Curators’ Distinguished Professor Emeritus of Biological Sciences vid University of Missouri, Columbia, USA.
- Sir Gregory P. Winter, född 1951 (67 år) i Leicester, Storbritannien. Fil.
dr 1976 vid University of Cambridge, UK. Research Leader Emeritus vid MRC
Laboratory of Molecular Biology, Cambridge, Storbritannien.
Halva prissumman på 9 miljoner svenska kronor går till Frances Arnold och andra hälften delas av George Smith och Gregory Winter.